Cục Quản lý dược (Bộ Y tế) vừa ban hành 2 quyết định xử phạt hành chính 140 triệu đồng đối với 2 công ty; đồng thời buộc thu hồi, tiêu hủy toàn bộ 2 lô thuốc vi phạm chất lượng mức độ 2.
Cụ thể, Công ty cổ phần 23 tháng 9 (địa chỉ trụ sở chính: quận 6, TP HCM) bị xử phạt vi phạm hành chính 70 triệu đồng. Lý do xử phạt công ty này sản xuất thuốc Batiwell (số giấy đăng ký lưu hành VD-31011-18, số lô 00121, ngày sản xuất 8-3-2021, hạn dùng 8-3-2024) không đạt tiêu chuẩn chất lượng về chỉ tiêu độ đồng đều thể tích và độ đồng đều hàm lượng (vi phạm mức độ 2).
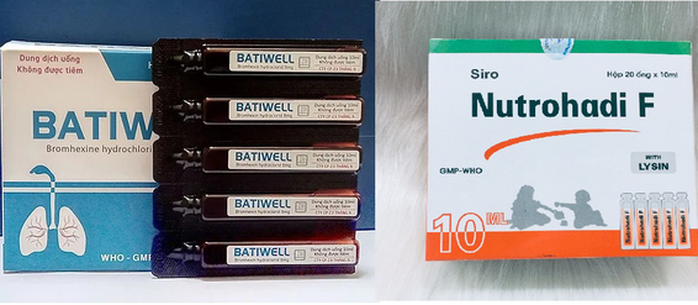
2 lô thuốc vi phạm chất lượng vừa Cục Quản lý dược xử phạt
Batiwell là chất có tác dụng long đờm, thuốc dung dịch uống Batiwell được chỉ định để hỗ trợ điều trị nhiễm khuẩn đường hô hấp cấp...
Đơn vị thứ 2 bị Cục Quản lý dược xử phạt là Công ty Cổ phần Dược Hà Tĩnh (TP Hà Tĩnh, tỉnh Hà Tĩnh). Doanh nghiệp này cũng bị xử phạt hành chính 70 triệu đồng do sản xuất thuốc vi phạm chất lượng mức độ 2 đối với với một lô thuốc Nutrohadi F .
Thuốc này có số giấy đăng ký lưu hành VD-18684-13, số lô: 030221, ngày sản xuất 24-2-2021, hạn dùng 23-2-2024.
Nutrohadi F là một dạng thuốc bổ sung các nhóm vitamin, khoáng chất và acid amin. Thuốc được chỉ định cho các đối tượng có chế độ ăn không cân đối hay thiếu dinh dưỡng, trẻ biếng ăn, giai đoạn trẻ đang tăng trưởng, thời kỳ dưỡng bệnh, đang có bệnh mạn tính, bệnh nhiễm khuẩn, bệnh nhân bỏng, bị mụn rộp…
Trước đó, Cục Quản lý Dược cũng thông báo đình chỉ lưu hành, thu hồi 6 lô thuốc Greaxim do xuất xưởng trước khi có kết quả kiểm tra chất lượng nguyên liệu và thành phẩm. 6 lô thuốc bột pha tiêm gồm ba lô Greaxim 2 g và ba lô Greaxim 1g, do Công ty cổ phần Am Vi, TP HCM xuất xưởng. Cục Quản lý Dược xác định sản phẩm được xuất xưởng trước khi có kết quả kiểm tra chất lượng là vi phạm quy định tại Luật Dược, phải thu hồi.
Greaxim có thành phần hoạt chất chính là Cefotaxim, được chỉ định điều trị bệnh nhân nhiễm khuẩn nặng như: nhiễm khuẩn huyết, viêm phổi, viêm màng não, viêm phổi, áp xe não...





Bình luận (0)