Thông báo được đưa ra bởi hãng dược Anh - Thụy Điển hôm 7-5, áp dụng cho vắc-xin Vaxzevria (AZD1222) được sản xuất dựa trên sự hợp tác với Đại học Oxford (Anh), vẫn thường được công chúng gọi là "vắc-xin COVID-19 AstraZeneca".
Astrazeneca cũng cho biết họ sẽ tiến hành rút giấy phép tiếp thị vắc-xin này ở châu Âu, theo Reuters.
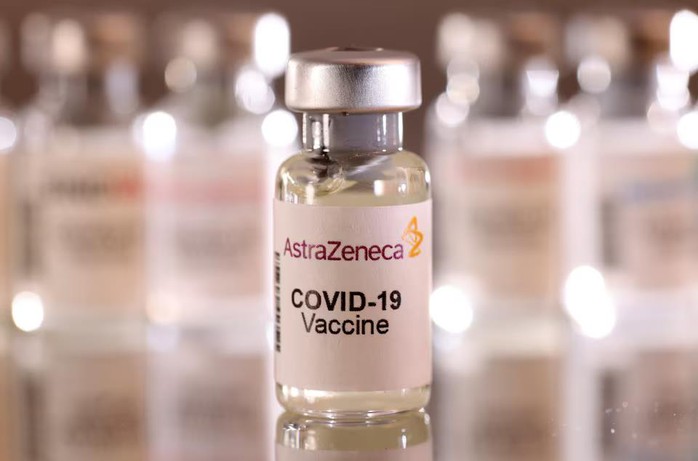
AstraZeneca bắt đầu thu hồi vắc-xin ngừa COVID-19 - Ảnh: REUTERS
Theo hãng dược, quyết định này được đưa ra do thị trường hiện có nhiều lại vắc-xin COVID-19 cập nhật dựa theo các biến thể mới, dẫn đến dư thừa và nhu cầu về vắc-xin của AstraZeneca đã giảm.
Theo tờ Telegraph, tờ báo đầu tiên đưa tin về diễn biến này, đơn xin rút vắc-xin của công ty này được đưa ra từ ngày 5-3 và có hiệu lực vào ngày 7-5.
Trước đó, hãng dược này đã gây chú ý khi thừa nhận trong các tài liệu tòa án rằng vắc-xin COVID-19 của họ có thể gây ra các tác dụng phụ hiếm gặp như huyết khối (cục máu đông) và giảm tiểu cầu.
Tuy nhiên, theo các nghiên cứu chi tiết, tác dụng này chỉ giới hạn trong một số ngày đầu sau khi tiêm.
Một thống kê của Bộ Y tế Úc dựa trên dữ liệu trong nước cho thấy nguy cơ xảy ra tác dụng phụ huyết khối và giảm tiểu cầu thường chỉ tồn tại trong 4-42 ngày sau khi tiêm liều đầu tiên; tỉ lệ rủi ro là 2/100.000 ở người trên 60 tuổi và 2-3/100.000 ở người dưới 60 tuổi.
AstraZeneca (có trụ sở tại London - Anh) đã bắt đầu chuyển sang sản xuất vắc-xin ngừa vi rút hợp bào hô hấp và thuốc trị béo phì vào năm ngoái sau khi tăng trưởng chậm lại do doanh số các sản phẩm liên quan đến COVID-19 giảm.




Bình luận (0)